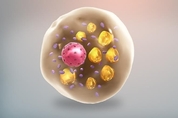
우리 몸엔 백색과 갈색 두 가지 지방 조직이 있다. 백색 지방세포의 본질은, 하나의 큰 지질 방울 형태로 축적된 불활성 에너지 용기(容器)라는 것이다. 이와 달리 갈색 지방세포엔 어두운 색조의 미토콘드리아와 뒤섞인 여러 개의 작은 지질 방울이 들어 있다. 미토콘드리아는 갈색 지방의 미세 지질 방울을 열과 에너지로 바꾸는 '엔진' 역할을 한다. 일부이긴 하나 백색 지방 조직 안에 베이지색 지방세포가 존재하는 경우도 있다. 이런 베이지색 지방세포 역시 칼로리를 태울 때 활성화한다. 갈색 또는 베이지색 지방 세포가 관심을 끄는 건 비만이나 2형 당뇨병 치료에 열쇠가 될 수 있기 때문이다. 최근엔 이런 대사 질환의 치료법을 찾기 위해 갈색(또는 베이지색) 지방세포의 활성도를 높이는 연구가 많이 이뤄지고 있다. 하지만 관련된 생리 과정이 워낙 복잡해 아직 이렇다 할 성과는 내지 못했다. 그런데 비만 치료의 해법이 될 수도 있는 주목할 만한 연구 결과가 나왔다. 비만 상태에서 에너지 사용과 열 생성을 제어할 수 있는, 지금까지 알지 못했던 세포 경로가 발견된 것이다. 핵심 역할을 하는 건 지방세포의 글리코겐이었다. 이 연구를 주도한 미국 샌디에이고 캘리포니아대(UCSD
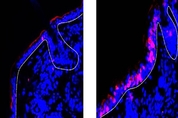
팔다리 관절 부위 피부와 두피, 엉덩이 등에 하얀 각질, 붉은 반점, 발진 등이 반복적으로 생기는 건선(乾癬·psoriasis)은 대표적인 만성 피부질환이다. 일단 증상이 나타나면 10~20년 지속하는 경우가 허다하고 일시적으로 나아져도 언제든 재발할 수 있다. 인구의 1~2%가 걸리는데 아직 근원적인 치료법은 나오지 않았다. 정확한 원인도 밝혀지지 않았지만, 피부의 T세포 활동이 늘어나면서 면역 물질의 자극으로 각질 세포가 과도히 분열하고 염증이 생긴다는 연구 보고가 나왔다. 요즘엔 건선을 만성 염증성 자가면역 질환으로 보기도 한다. 면역세포와 면역 신호 전달물질의 복잡한 네트워크에 변화가 생겨 건선을 유발한다는 것이다. 최근엔 인터류킨 치료제와 관련해 주목할 만한 임상 시험 결과가 나왔다. 인터류킨-23만 차단하는 신약이, 인터류킨-23과 인터류킨-12를 동시에 차단하는 기존 치료제보다 더 효과적이라는 것이다. 스위스 취리히대(UZH) 과학자들이 인터류킨-12가 건선에 어떤 작용을 하는지 상세한 분자 메커니즘을 밝혀냈다. 염증 반응을 촉진하는 것으로 알려진 인터류킨-12가 건선에선 각질 형성을 억제하는 것으로 나타났다. 인터류킨(약칭 IL)은 우리 몸의
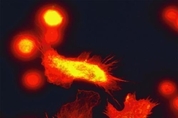
종 코로나바이러스 감염증(코로나19), 패혈증, 세균 감염, 기생충 감염, 부상 등이 심해지면 급성 빈혈로 이어질 수 있다. 실제로 응급실 환자 중엔 이런 빈혈로 병세가 위중해지는 사례가 적지 않다. 우리 몸 안의 산소 공급 과정에서 핵심 역할을 하는 건 적혈구다. 순환 혈액의 적혈구가 빠르게 감소해 급성 염증성 빈혈로 진행하는 메커니즘을 미국 펜실베이니아대 과학자들이 밝혀냈다. 코로나19 같은 감염증이 생기면 환자의 혈액에 세포 유리 DNA(cell-free DNA), 즉 핵산이 나타나는데 적혈구는 이런 핵산과 잘 결합하는 성질을 가진 것으로 드러났다. 핵산과 결합한 적혈구는 비정상인 구조로 변해 무더기로 면역세포에 잡아먹혔고, 그 결과 숫자가 급격히 줄면서 빈혈과 염증을 촉발했다. 이 과정에서 적혈구는 일종의 면역 센서 역할도 하는 것으로 확인됐다. 펜실베이니아 의대의 닐람 망갈무르티(Nilam Mangalmurti) 의학 조교수 연구팀이 수행한 이 연구 결과는 20일(현지 시간) 저널 '사이언스 중개 의학(Science Translational Medicine)'에 논문으로 실렸다. 논문의 수석 저자인 망갈무르티 교수는 "급성 염증성 빈혈은 말라리아 원
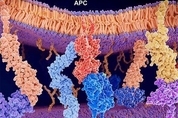
보통 24시간 주기로 작동하는 생체 시계(Circadian clocks,)는 우리 몸의 가장 기초적인 생물학적 메커니즘 가운데 하나다. 그런데 하루 중 어느 시간대인지에 따라 면역계의 활성도가 다르다는 연구 결과가 나왔다. 인체의 면역계도 생체 시계의 제어를 받는다는 의미다. 과학자들은 면역세포의 이동 메커니즘을 분석해 이 같은 결론에 도달했다. 이 연구는 스위스 제네바대(UNIGE)와 독일 루트비히-막시밀리안 대학(LMU) 과학자들이 함께 수행했다. 관련 논문은 18일(현지 시각) 저널 '네이처 이뮤놀로지(Nature Immunology)'에 실렸다. 연구팀은 피부의 면역세포가 림프절까지 이동하는 걸 관찰해 면역계가 생체 리듬에 따라 상승·하락한다는 걸 발견했다. 면역 기능은 다시 활성화되기 직전의 휴식기에 정점에 도달했다. 야행성 동물인 생쥐에겐 오후, 사람에겐 아침이 그 시점이었다. 이 발견은 앞으로 백신 접종이나 항암 면역치료 등에 중요한 참고가 될 수 있다. 효과를 높이기 위해선 접종이나 치료 시간대를 고려해야 한다는 의미다. 따로 표적을 정하진 않지만, 즉각 반응하는 선천 면역과 달리 적응 면역은 개별 감염원을 표적으로 삼는 장기 반응을 구축한다.
농산물, 수산물, 축산물 등을 인공적으로 처리해 조리와 보존이 간편하게 만든 걸 통칭 가공식품이라고 한다. 미국 하버드대 등의 연구진은 지난달, 빨리 흡수되는 가공 탄수화물을 많이 섭취하는 게 비만의 주원인이라는 연구 결과를 내놨다. 미국 영양학회(ASN) 저널에 실린 관련 논문의 요지는, 단순히 덜 먹으려고만 하지 말고 고가공(highly processed) 탄수화물 섭취를 줄여야 비만을 막을 수 있다는 것이었다. 그런데 나이가 들면 고가공 식품을 단기간 섭취해도 기억력 저하를 동반하는 강한 염증 반응이 뇌에 나타난다는 연구 결과가 나왔다. 특히 나이 든 동물은 4주만 고가공식을 먹어도 뇌에 이런 증상이 나타났다. 이 연구는 미국 오하이오 주립대 행동의학 연구소의 루스 바리엔토스(Ruth Barrientos) 부교수 연구팀이 수행했다. 관련 논문은 미국 신경정신면역연구학회(Psychoneuroimmunology Research Society) 저널인 '뇌·행동·면역(Brain, Behavior, and Immunity)' 최신호에 실렸다. 논문의 수석저자인 바리엔토스 교수는 "가공식품을 섭취하면 심하고 갑작스러운 기억 손상이 생길 수 있다는 걸 시사한다"라
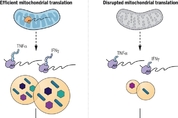
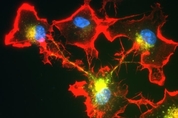
세포 면역에 중요한 역할을 하는 T세포는 외부 침입자를 파괴하는 킬러 T세포(killer T cells)와 외부 침입을 B세포에 알리는 '헬퍼 T세포(helper T cells)'로 나뉜다. 세포 독성을 띠는 킬러 T세포는, 면역계가 훈련을 통해 길러내는 일종의 '파괴 전문가'다. 킬러 T세포는 코로나19(신종 코로나바이러스 감염증) 퇴치에도 중요한 역할을 한다. 혈액 면역의 중심인 항체가 바이러스의 세포 감염을 차단한다면, 킬러 T세포는 감염 세포를 직접 파괴한다. 킬러 T세포의 공격 대상엔 암세포도 포함된다. T세포가 유망한 항암 면역치료의 중심이 되는 이유가 여기에 있다. T세포의 숨겨진 강점은 여러 개의 표적을 연속해서 파괴하는 데 있다. 이렇게 하려면 T세포는 공격 무기인 독성 단백질을 계속 충전해야 한다. 그런데 과학자들은 지금까지 T세포가 어떻게 독성 물질을 계속 분비하는지 알지 못했다. 영국 케임브리지대 과학자들이 마침내 그 비밀을 풀어냈다. T세포가 공격 무기를 계속 탑재하는 덴 미토콘드리아가 핵심 역할을 했다. 케임브리지대 의학 연구소의 길리안 그리피스 교수 연구팀이 수행한 이 연구 결과는 15일(현지 시간) 저널 '사이언스'에 논문으로 실
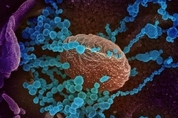
코로나19(신종 코로나바이러스 감염증)를 앓고 나서도 여러 가지 후유증으로 힘들어하는 사람이 많다. 학계에선 이를 '장기 코로나(long COVID)' 또는 '포스트 코로나(post-COVID)' 증상이라고 한다. 이런 코로나19 후유증이 왜 생기는지 그리고 코로나19로부터 회복한 사람 가운데 어느 정도가 후유증을 앓는지는 지금까지 확실히 밝혀지지 않았다. 그런데 코로나19 환자의 절반은 회복한 뒤에도 6개월 넘게 후유증에 시달릴 수 있다는 연구 결과가 나왔다. 연구팀은 각국의 보건 의료계에 엄청난 부담을 안겨줄 거라면서 체계적이고 현실적인 '포스트 코로나' 대책을 마련해야 한다고 제안했다. 미국 펜실베이니아 주립대 의대 과학자들이 수행한 이 연구 결과는 13일(현지 시각) 미국 의사협회가 발행하는 '자마 네트워크 오픈(JAMA Network Open)'에 논문으로 실렸다. 연구팀은 포스트 코로나가 포함된 세계 각국의 관련 연구 보고 57건을 종합적으로 리뷰했다. 여기엔 코로나 팬데믹이 처음 불거진 2019년 12월부터 올해 3월까지 백신을 맞지 않은 채 확진 판정을 받은 성인과 아동 2만5천351명의 의료 데이터가 들어 있었다. 이 가운데 79%가 입원 치
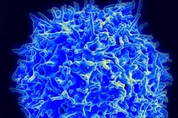
코로나19(신종 코로나바이러스 감염증)에 대한 장기 면역은, 기억 B세포(memory B cells)가 신종 코로나바이러스(SARS-CoV-2)의 항원결정기(epitope)를 얼마나 잘 기억하는지에 달렸다. 수개월만 지나면 약해지기 시작하는 혈액 순환 항체와 달리 기억 B세포는 훨씬 더 오래 살면서 신종 코로나가 다시 침입했을 때 즉각 중화항체를 만들어낸다. 코로나19 백신 접종자 가운데 상당수가 '돌파 감염'을 피하지 못하는 현실도, 현재의 백신이 장기 면역 기억을 충분히 유도하지 못하기 때문이다. 미국 록펠러대 연구진은 최근 신종 코로나에 감염됐을 때 만들어지는 기억 B세포가 장기 면역력 형성에 탁월한 효능을 보인다는 연구 결과를 저널 '네이처(Nature)'에 발표했다. 이 연구팀은 또 신종 코로나 감염 시 생기는 기억 B세포가 mRNA 백신을 맞았을 때보다 중화 작용을 더 잘하는 항체를 생성한다고 보고했다. 그런데 신종 코로나에 감염됐다가 회복하면 폐와 주변 조직에 장기 면역 기억이 저장된다는 연구 결과가 또 나왔다. 한번 코로나에 감염됐던 면역 기억이 폐와 그 주변 림프절의 T세포, B세포에 저장된다는 것이다. 미국 컬럼비아 의대의 도나 파버 미생물
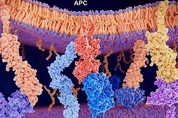
폐의 면역계는 각종 폐 질환을 퇴치하는 데 꼭 필요하다. 코로나19(신종 코로나바이러스 감염증)는 물론이고 폐렴, 폐암, 천식 등도 예외가 아니다. 그런데 폐 면역은 전신 면역(systemic immunity)과 다르며, 폐 면역의 생성과 조절이 어떻게 이뤄지는지에 대해선 밝혀진 게 별로 없다. 보통 생물의학 연구의 초점은 전신 면역에 맞춰지기 때문이다. 지금까지 베일에 싸였던 폐 면역계의 작동 메커니즘을 미국 보스턴의대(BUSM) 과학자들이 밝혀냈다. 전체적으로 폐 면역을 조직하는 건 폐 조직의 상피세포였다. 이 과정에서 MHC-Ⅱ(주조직 적합성 복합체 Ⅱ형)가 폐 안에 상주하는 기억 T세포(TRM)의 위치와 기능을 제어하는 데 핵심 역할을 했다. MHC는 관련 단백질을 암호화하는 유전자군을 말하며, 인간은 누구나 서로 다른 MHC 대립형질을 갖고 있다. MHC 단백질은 크게 Ⅰ형과 Ⅱ형 두 가지로 나누는데, T세포는 모든 세포 표면에 나타나는 MHC-Ⅰ형 단백질을 보고 자기 세포인지, 침입 세포인지를 식별한다. MHC-Ⅱ형 단백질은 B세포, 대식세포 등 특정 면역세포에만 존재하는 것으로 알려졌다. 예컨대 대식세포는 침입 항원을 삼켜 없앤 뒤 남은 찌꺼기를