![<strong>독감백신 예방접종 (CG) [연합]</strong>](http://www.hmj2k.com/data/photos/20250310/art_17414075736349_6c1399.jpg)
세계보건기구(WHO)가 지난달 28일 북반구의 2025~2026년 인플루엔자(독감) 백신 바이러스 구성 권장 사항을 발표함에 따라 백신 기업들이 올해 하반기 독감 시즌 준비에 나섰다.
WHO는 해마다 2월과 9월 북반구와 남반구 독감 시즌을 대비해 전문가 회의를 거쳐 다음 시즌 백신 구성을 논의한다.
WHO는 A형 H1N1, A형 H3N2와 B형 빅토리아 계열 등 3가 백신을 권장하고, 4가 백신에는 B형 야마가타 계열을 추가하는 것을 권장했다.
4가 백신으로 예방하는 야마가타 계열이 2020년 3월 이후로 사라지면서 지난해 WHO가 이를 배제하는 것을 권고하면서다.
코로나19 발발로 독감 바이러스 전체가 약세를 보인 가운데 2019년과 2020년 빅토리아 계열 대비 약세를 보여왔던 야마가타 계열이 균주 감시에서 완전히 사라진 것이다.
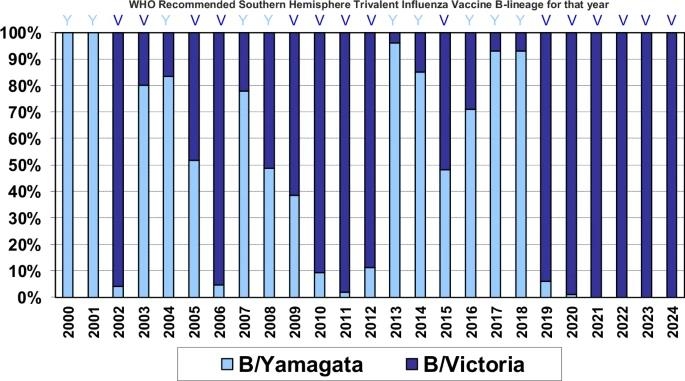
야마가타 계열은 2018년 전 세계 B형 독감 바이러스의 90%를 차지하며 우세했지만 2019년부터 10% 아래로 떨어졌고, 2020년 3월 이후에는 백신 균주와 같은 검체 외에는 보고되지 않고 있다.
때문에 학계에서는 균주 감시가 진행되지 않은 국가가 많은 만큼 멸종을 선언하기는 힘들지만, 사실상 멸종 직전이라는 의견이 우세하다.
그러면서 4가 백신을 3가로 변경해야 할지 아니면 4가 백신의 성분을 조정할지에 대한 논의도 이어지고 있다.
칸타 수바라오 호주 WHO 인플루엔자 연구협력센터 박사는 지난해 11월 국제학술지 'npj 백신'에 3가 백신으로 변경할 경우 더 많은 독감 백신을 생산할 수 있고, 백신 성분 권고를 더 빨리 내릴 수 있어 유행 바이러스에 대한 검토에 유리하다고 설명했다.
다만 4가 백신에 A형 바이러스를 추가하거나 개선하는 방법도 고려해 볼 수 있다며, 특히 A형 H3N2 백신 효능이 수년 동안 떨어지는 점을 지적했다.
가장 중요한 점은 코로나19의 몇 안 되는 긍정적 효과로 사라진 야마가타 B 바이러스의 유출 등을 최대한 차단해 재등장을 막는 것이라고 전문가들은 지적한다.
수바라오 박사는 "과학자들과 실험실은 바이러스 샘플에 대한 노출을 최소화해 재등장 가능성을 줄여야 한다"며 "10년 후에는 국제 패널 재검토 등을 통해 실험실에서 야마가타 바이러스 보관을 재검토해야 한다"고 말했다.




